4. 토양의 화학적 성질
<목차>
1. 식물의 필수 영양소: 17가지
2. 토양 내 무기양료
3. 토양 내 양분가용성에 영향을 미치는 요인
4. 토양의 반응
1. 식물의 필수 영양소: 17가지
■ 식물조직의 구성 성분: Ca, Mg, N, S, P 등
■ 대량원소: 식물체내 이동 쉬움(N P K)
■ 미량원소: 식물체내 이동 어려움(Fe Mn)


• 효소의 활성화 : Mg, Mn 등 대부분의 미량원소 ▲ Source: Wikipedia
• 삼투압 조절제 : K(기공), Na(내염성 식물)
• 완충제 : P, 유기산 완충제(Ca, Mg, K)
- 대량원소(macronutrients, major element) : 식물조직내에 건중량의 0.1%(1000ppm)이상 함유
- 미량원소(micronutrients, minor element) : 식물조직내에 건중량의 0.1%(1000ppm)이하 함유
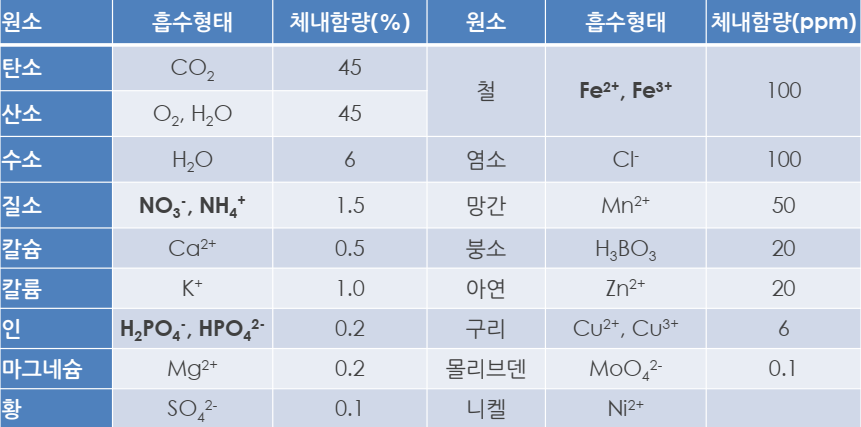
■ 필수영양원소의 식물체내 함량 및 이용형태
CHO & NO3-, NH4+, H2PO4-,Fe2+
☞ 탄수화물(炭水化物 carbohydrate): 탂소(Carbon), 수소(Hydrogen), 산소(Oxygen)의
화합물(CHO) -> 단백질, 셀룰로오스, 리그닌 등 복합 화합물 <- 건중량의 92%
2. 토양 내 무기양료
■ 토양 내 주요 무기 이온∙양료의 동태(動態)
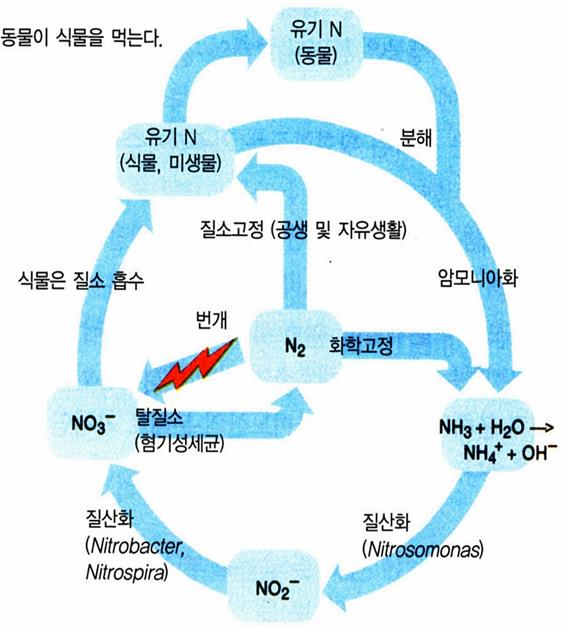
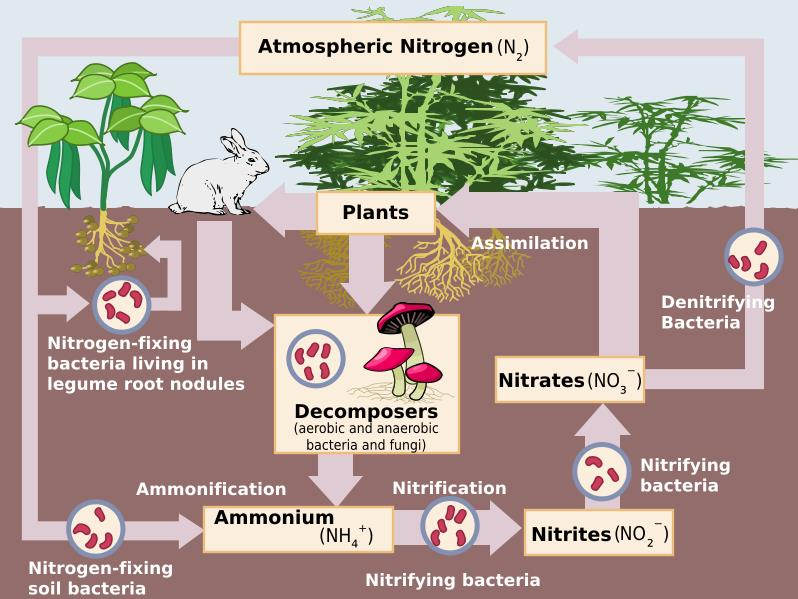
질소(窒素 N, Nitrogen)
N(Nutrient) ⇌ N2(Atmospheric Nitrogen)
유기태 질소(Organic Nitrogen)- 아미노산
• 토양내 유입원 : 작물의 수확잔재, 녹비, 화학
비료, 빗물속의 암모늄염과 질소산화물, 미생
물에 의한 대기 질소(N2)의 고정
• 토양외 이탈 : 작물의 수확, 배수, 침식 및
원소 또는 암모니아(NH 3)같은 기체로 소실
• 토양의 질소형태
상층토양(A층): 전질소의 95%이상이 유기태
(有機態) 질소→NH2 가 들어있는 질소화합
물
- 아미노산 질소 30-50%
- 아미노당 질소5-15%
- 아마이드 질소 15%,
- 비가수분해성 30%
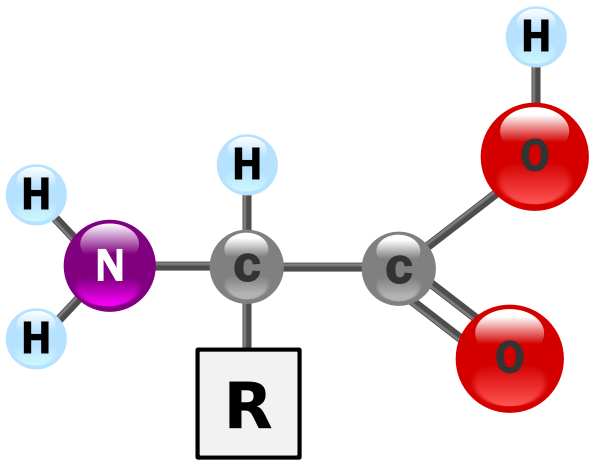
▲ 아미노산(Amino Acid → 단백질(蛋白質; protein)의 기본 구성 단위)의 구조 = NH
2 (아민基 amine group)+COOH(카르복실基 carboxylic group)
무기태 질소(Mineral Nitrogen)
• NH3 + H2O → NH4+ (암모늄)
• NH4+ + H2O → NO3- (질산)
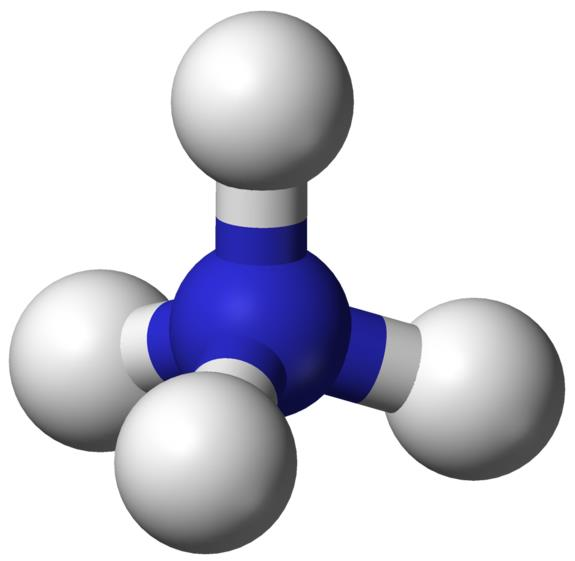
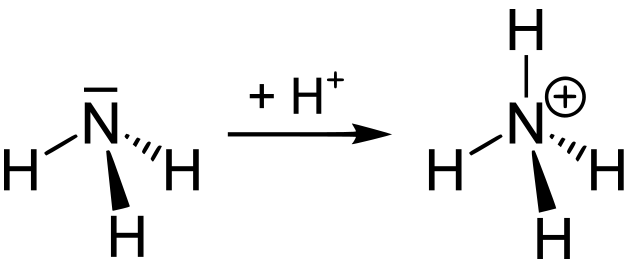
• 무기태 질소(無機態 窒素 Mineral Nitrogen → 식물에 유용)는 NH4+, NO3-가 주가 됨
• 암모늄(NH4+)은 빨리 질산(NO3- )으로 바뀌므로 교홖성으로 졲재하는 양은 적고, 대부분
은 규산염광물에 고정되어 비교홖성으로 존재.
• 따라서 하층토(下層土)에서는 유기태 질소 NH4+ 보다 함유량이 높다.
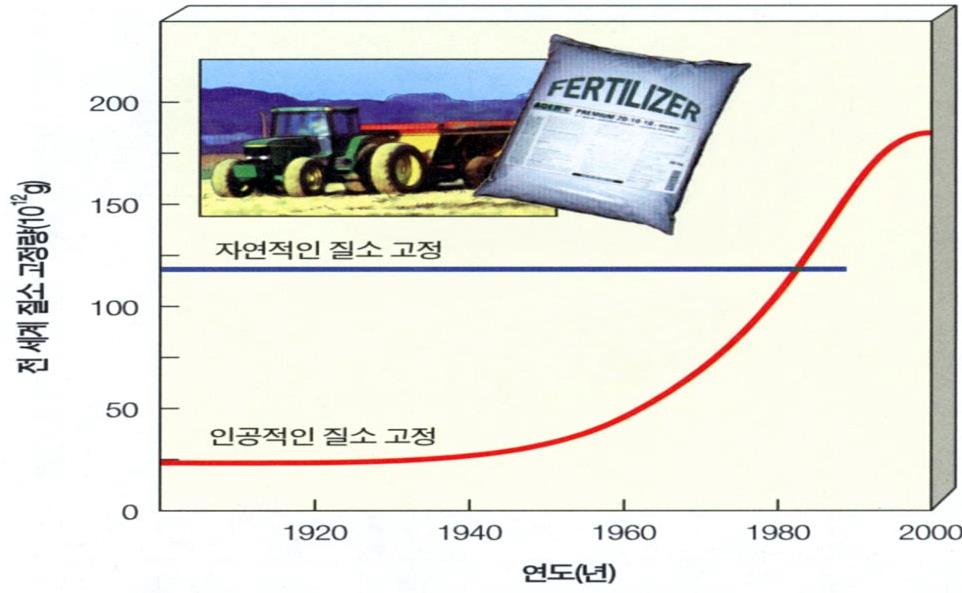
질소고정(Nitrogen Fixation)
대기 중의 비활성 질소 기체(N2 ) → 활성암모니아(NH3 ) 또는 질산염NO3
1) 미생물에 의한 생물학적 질소고정(Biological Nitrogen Fixation)
N2(공기 중 질소)+H+(식물의 광합성 산물 중 수소) → NH3(암모니아), NH3+H2O → NH4+(암모늄)
• Rhizobium: 콩과 식물의 뿌리혹(根瘤 Root Nodule)을 형성하는 박테리아(Leguminous
Bacteria) ☞ A legume in botanical writing is a plant in the family Fabaceae(콩科)
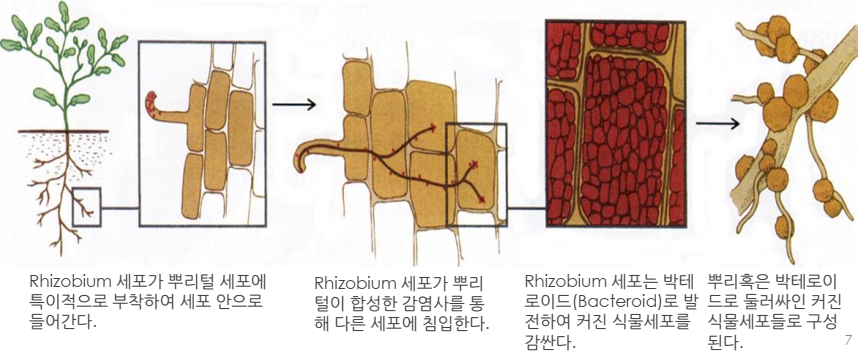
생물학적 질소고정 ← 미생물
N2 → NH3→ NH4+


광∙화학적 질소고정 (번개) N2 → NO3-
산업적 질소고정 (비료) N2 + 3 H2 ⇌ 2 NH3
2) 광∙화학적 질소고정 : 번개 등에 의핚 대기 중
전기방전에 의핚 고정
N2 → NO3-
3) 산업적 질소고정: 비료공장- 인위적인 합성
N2 + 3 H2 ⇌ 2 NH3
유기태 질소의 무기화(無機化)와 부동화(不動化)
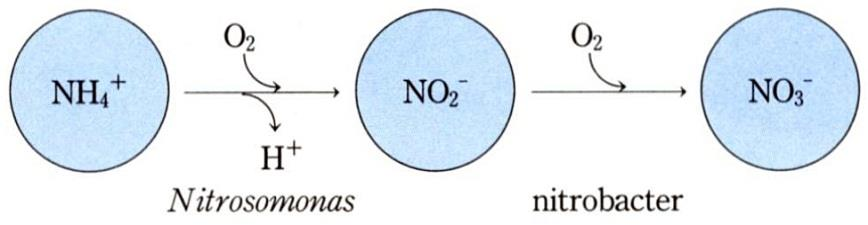
■ 암모늄화(ammonification) 또는 무기화(mineralization) : 호기성 박테리아와 균류 홗동.
질소의 무기화에 미치는 영향 : 유기물의 C/N비, pH, 함수량, 토양온도, 통기성.
■ 질산화작용(nitrification) : 호기성 질산화 박테리아, 두 단계(아질산 → 질산)로 짂행
■ 탈질작용(脫窒作用 denitrification) : 늪, 답압토양,
침수토양 등 산소가 부족핚 혐기성 조건에서
Pseudomonas와 같은 혐기성 박테리아에 의해 짂행
■ 질소의 부동화(immobilization) : 무기태 질소화합물 → 유기태로 변홖, 무기태 질소를 토
양 미생물이 흡수하여 단백질 등 생체 구성물질로 다시 동화시키는 반응임 → 뿌리 흡수 불가.
■ 질소의 洗脫 : 통기성이 좋은 홖경에서는 NO3, 투과성이 좋은 곳에서는 비료의 NH4가 그대
로 씻겨내려감. 농경지의 것이 세탃이 가장 심함(90%이상은 유기물에 들어있던 질소의 무기화 작용에 기인)
참고 1: 질소순환 모델
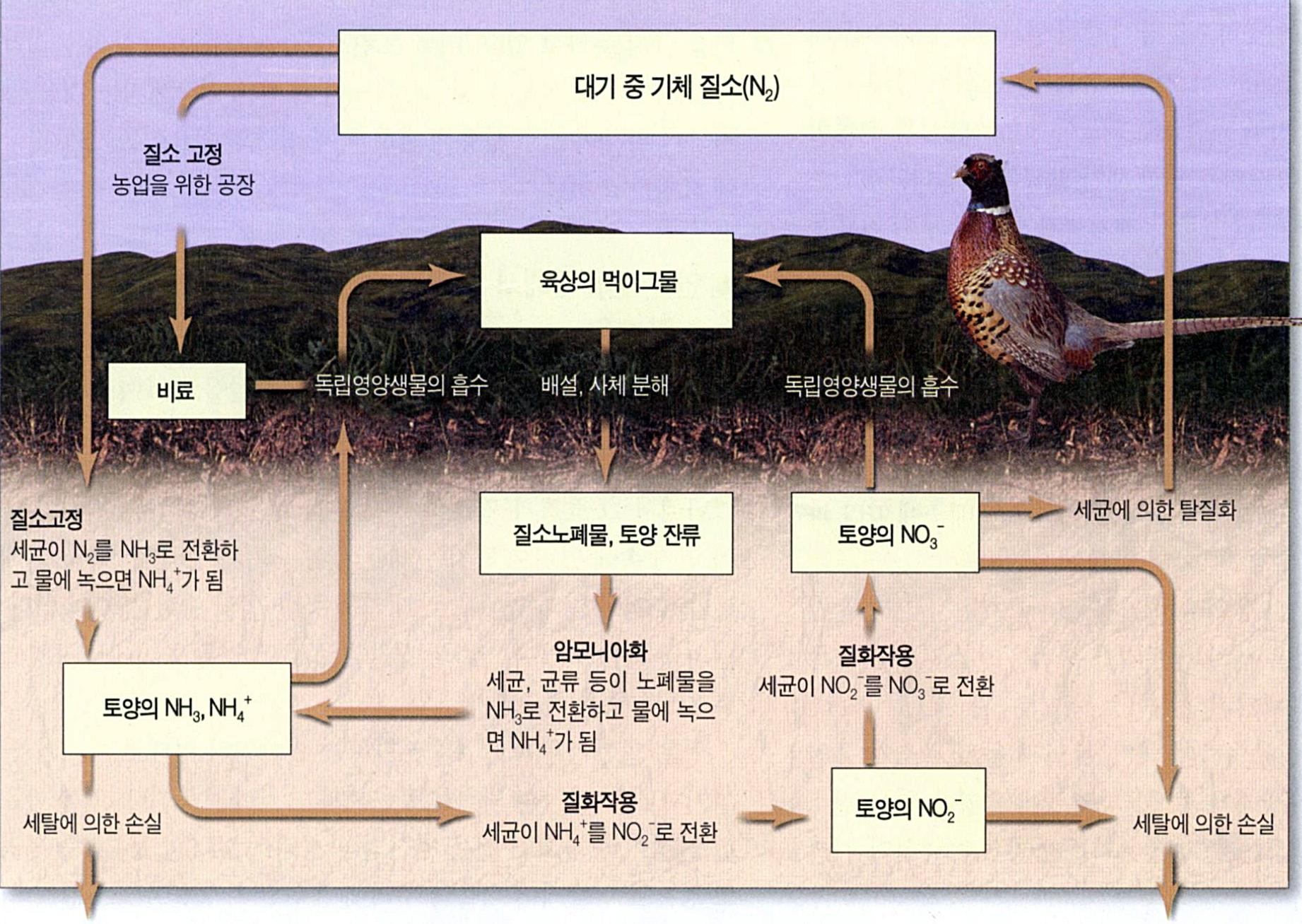
참고 2: Nitrogen Cycle
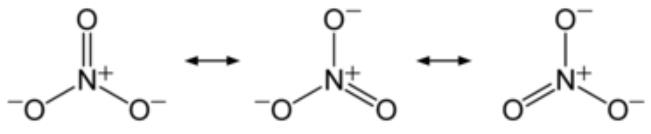
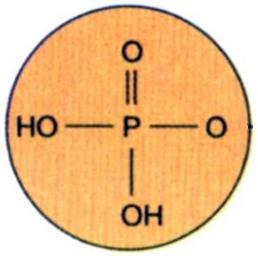
인산(燐酸 Phosphoric Acid)
H2PO4-, CaHPO4-, AlPO4-, FePO4-
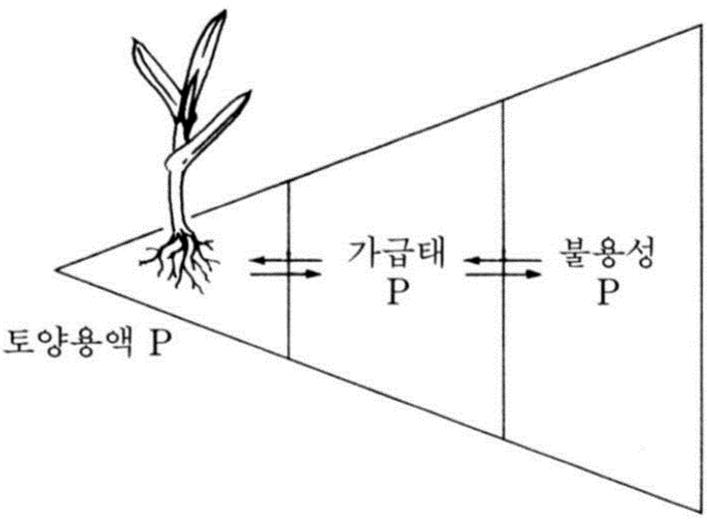
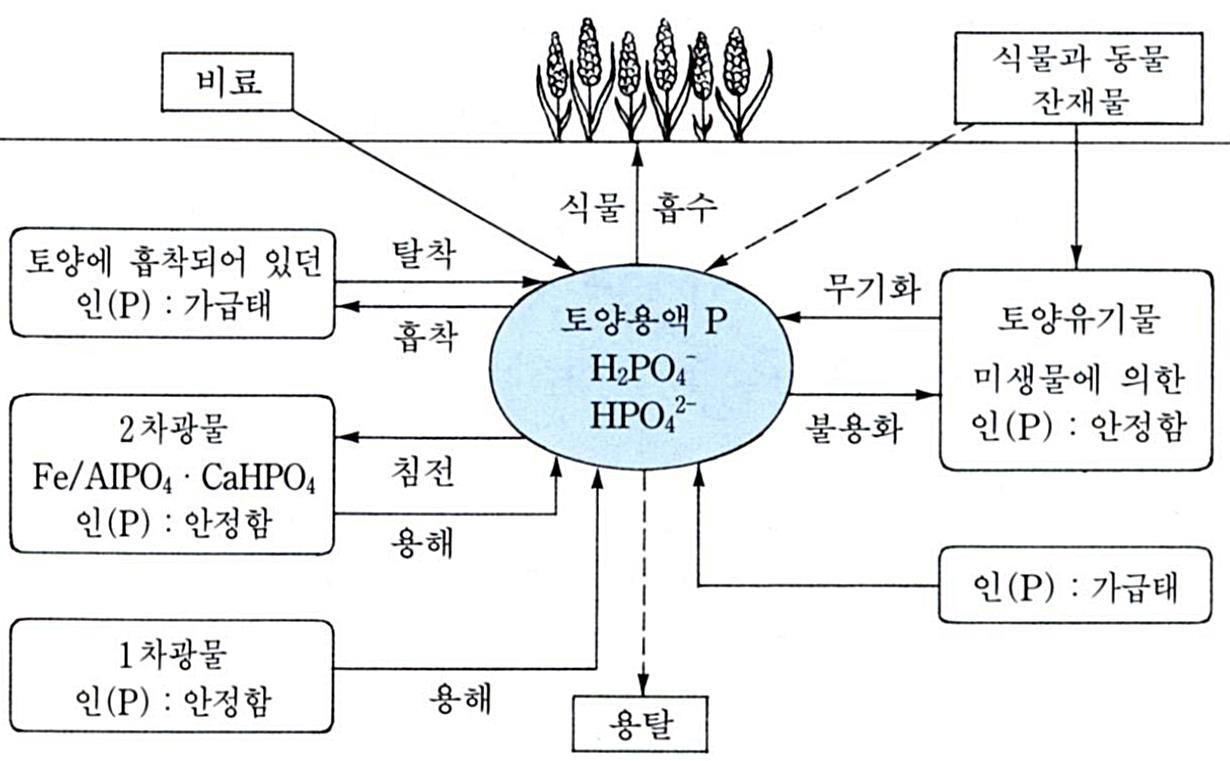
3. 토양 내 양분가용성에 영향을 미치는 요인
■ 토양 교질(土壤膠質 Soil Colloids)
교질(膠質 Colloid)
▪ 기체 또는 액체 중에 분산된 상태로 있는 물질
▪ 넓은 비표면적∙직경 2µm 이하 입자∙화학반응
▶ 매우 작은 고체상의 입자물질, 따라서 무게보다는 표면 특성이 더 중요
☞ 넓은 비표면적(比表面積)을 가짐.
▶ 대다수 교질의 직경은 마이크로미터보다도 더 작다.
☞ 점토 입자 직경인 0.002mm(= 2µm) 이하.
▶ 표면크기 대 질량비윣이 크기 때문에 현탁액에서 서서히 침전, 토양특성을 결정핛 수 있도록 그들의
표면에서 많은 반응(양이온 치환)을 한다.



점토 콜로이드: 크기 차이 뿐만 아니라 모래∙
미사와 서로 다른 화학적 성질을 가짐
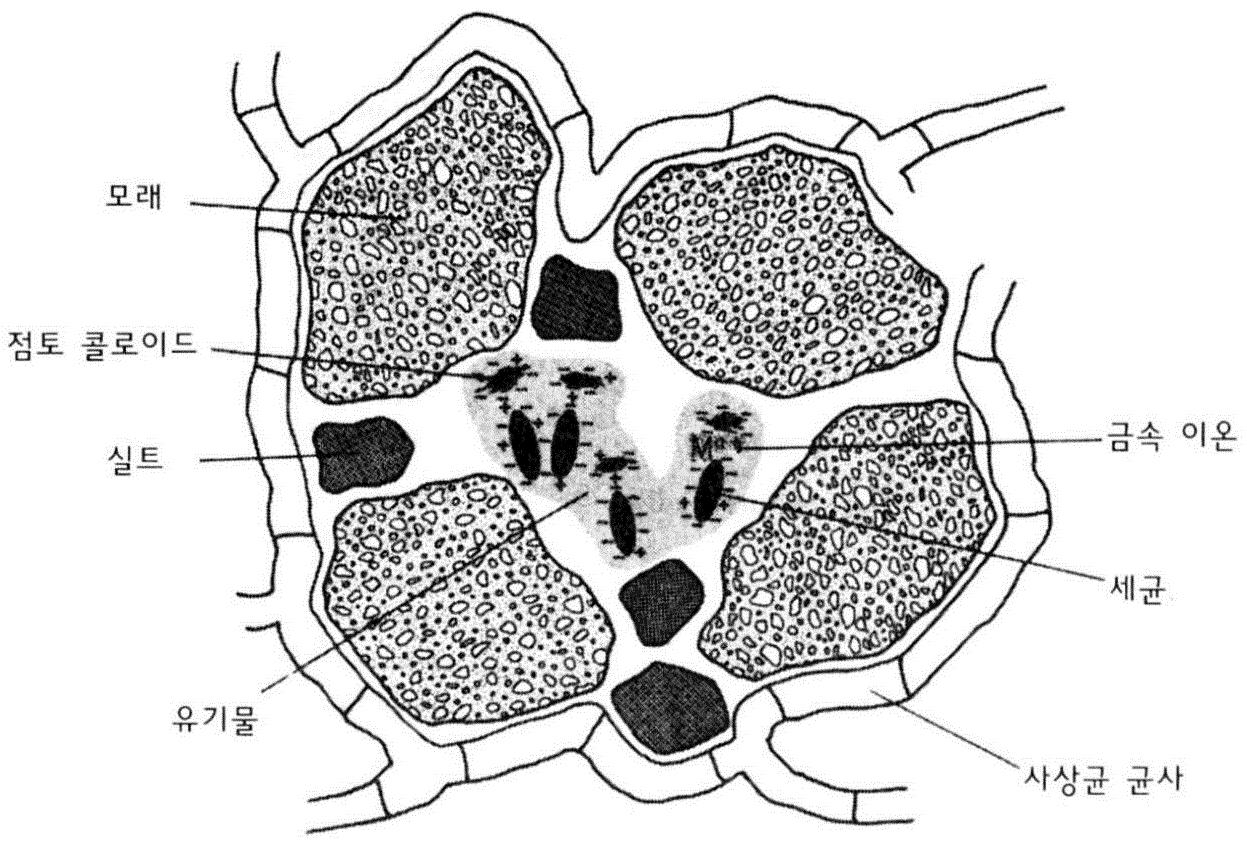
우점 토양 교질물 : 점토와 부식질
점토(Clay): 음이온 표면에서의 양이온 교환
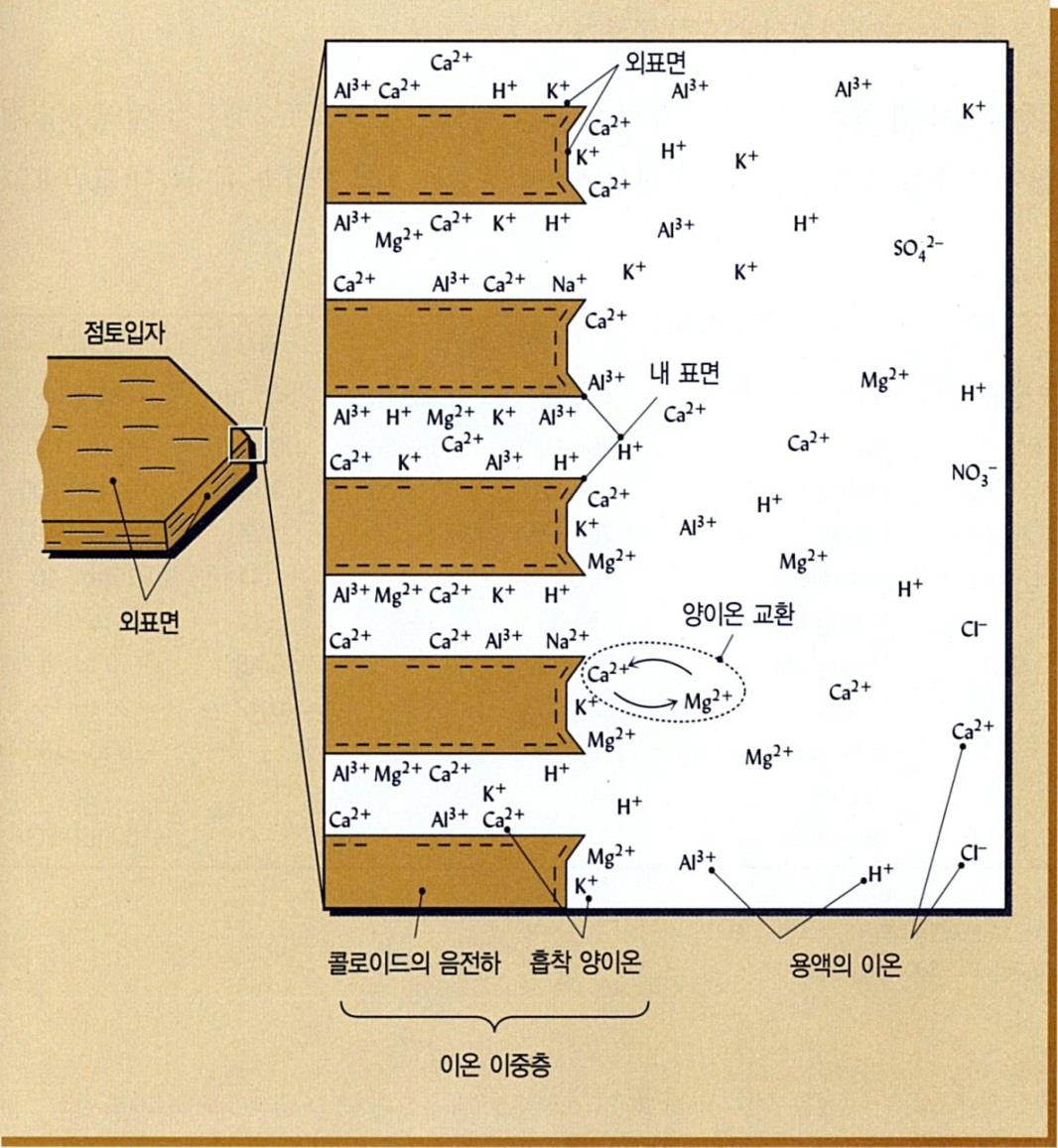
■ 우점 토양 교질물(1): 점토(clay)
• 점토는 그들의 입자 표면에 음전하를 띠고 있
어 양이온 을 끌어 흡착핚다.
(K+,Na+,NH4+,Ca2+,Mg2+,H+,Al[OH]2+)
• 점토에 의해 흡착되는 양이온의 양은 점토광
물의 종류에 따라 다르며, 식물뿌리는 양료로
서 이들 교환성 양이온을 이용핚다.
• 다년갂의 집중강수→ 점토로부터 교홖성 기
본 양이온 용탃(제거), 대체 양이온 요구
→ 이들 다른 양이온이 대체
←광물질 풍화에서 유래, 또는 이산화탂소
• 식물뿌리의 호흡과 유기물 분해에서 비롯되
는 탂산의 수소이온
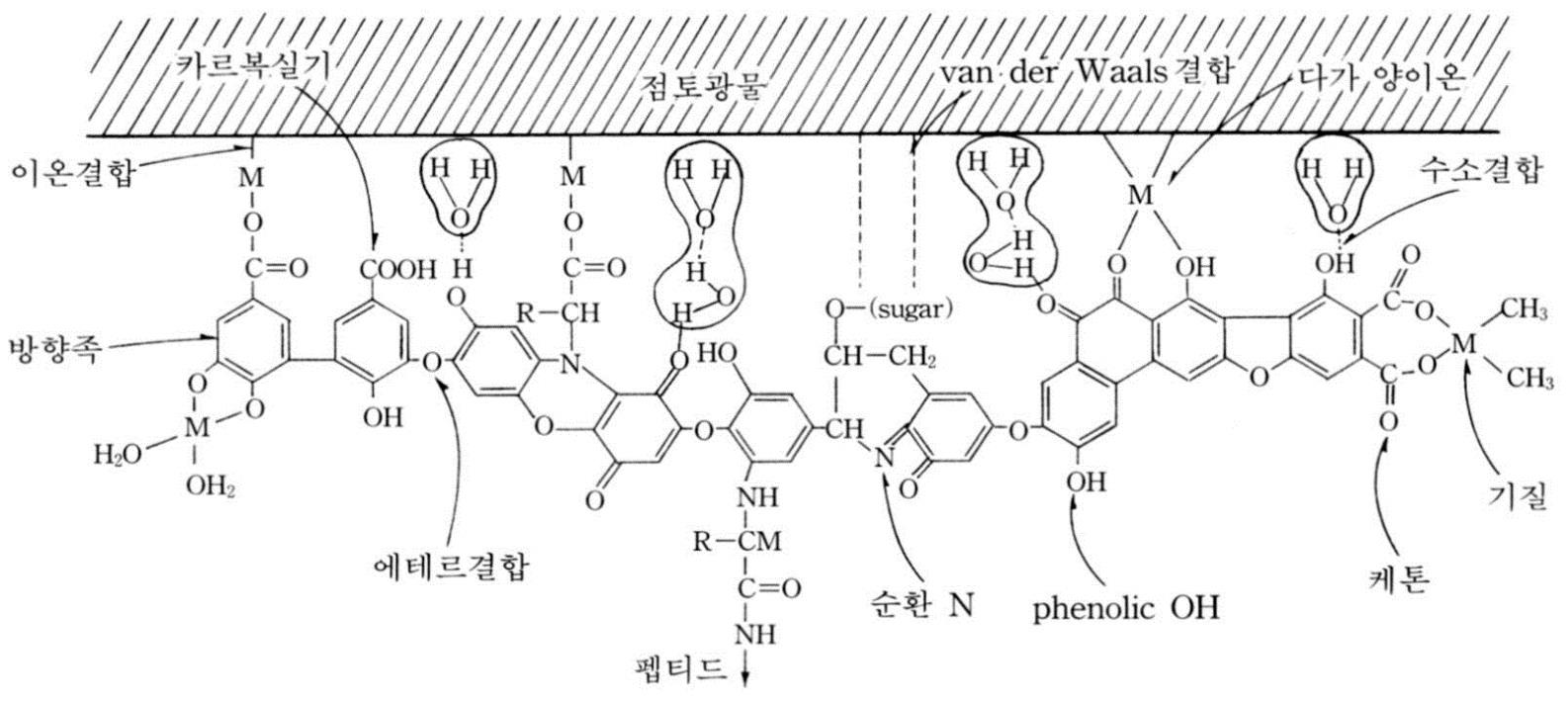
부식질(humus): 점토광물보다 큰 比표면적
교질물의 대전(帶電): 유기콜로이드- 음전하
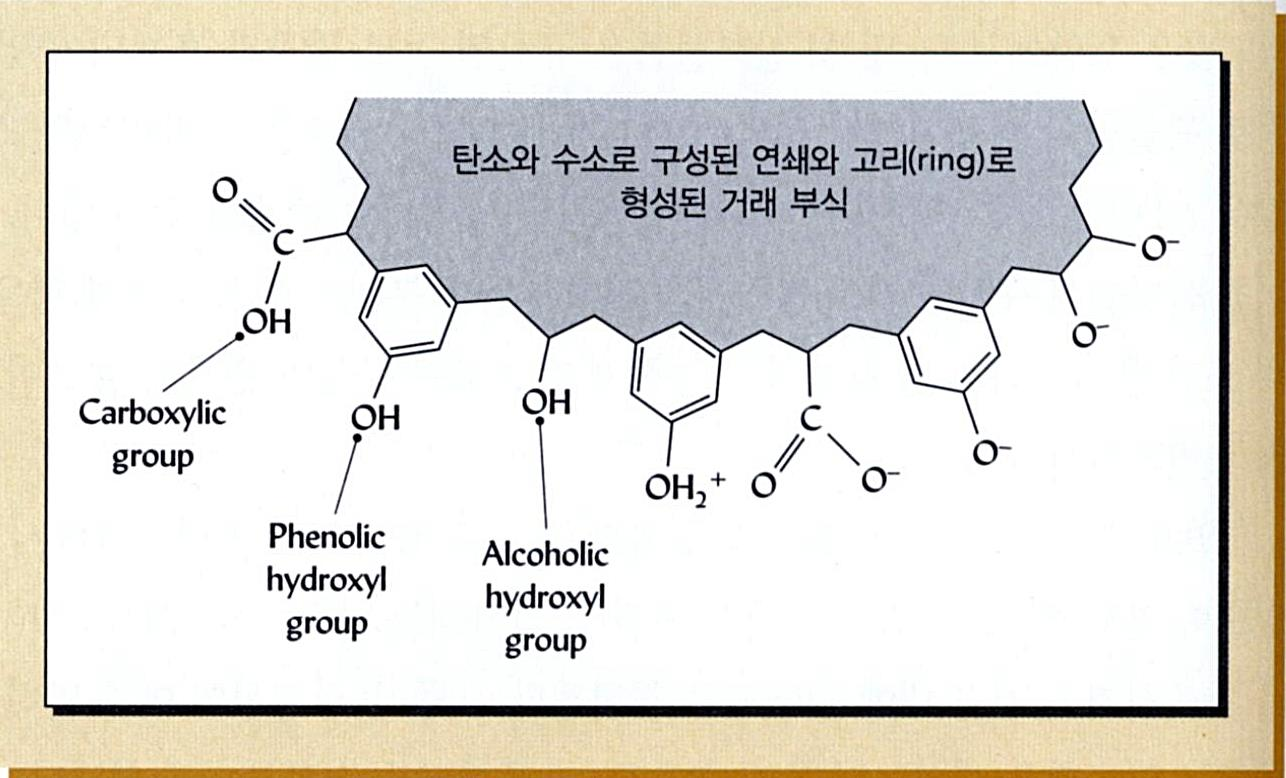
■ 교질물의 대전 (帶電 Electric Charge)
유기 콜로이드 (부식질)
전기적으로 음성을 띰(→ 陰電荷 Negative Charge).
← 카르복실기와 페놀성 수산화기의 해리(解離)에 기인
카르복실기 수소이온의 해리
(카르복실기 → 수소이온의
해리 → 전기적 음성도 증대)
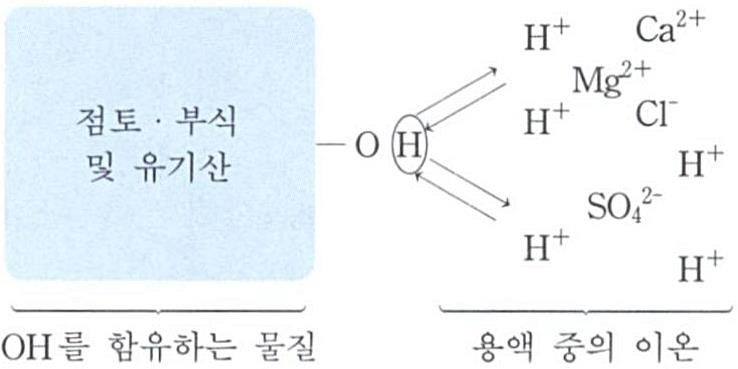
유기 콜로이드(부식질)
알칼리성 물질(= OH 함
유 물질) 첨가(pH증가)
→ 양기로부터 수소이온
방출 → 전기적 음성도
증대. 반면, 산 첨가(pH
감소) → 수소이온의 해
리 억제. 다른 부분인 아
미노기에 의해 양성을 띰.
동형치홖에 의핚 음성(Negative Charge):
Al3+ + 2O2- → Mg2+ + O2 -: O2 – (음이온) 流
■ 동형치환(同形置換 Isomorphic Substitution)
점토광물이 생성될 때 사면체나 팔면체의 판자(sheet)에 있는 양이온들, 즉 Si, Al, Mg 등 크기
가 비슷핚 양이온들은 서로 교홖될 수 있음. 이와 같이 크기가 유사핚 원소가 다른 원소의 자리
를 대싞해 차지하는 과정을 동형 치홖(교홖)이라고 함.
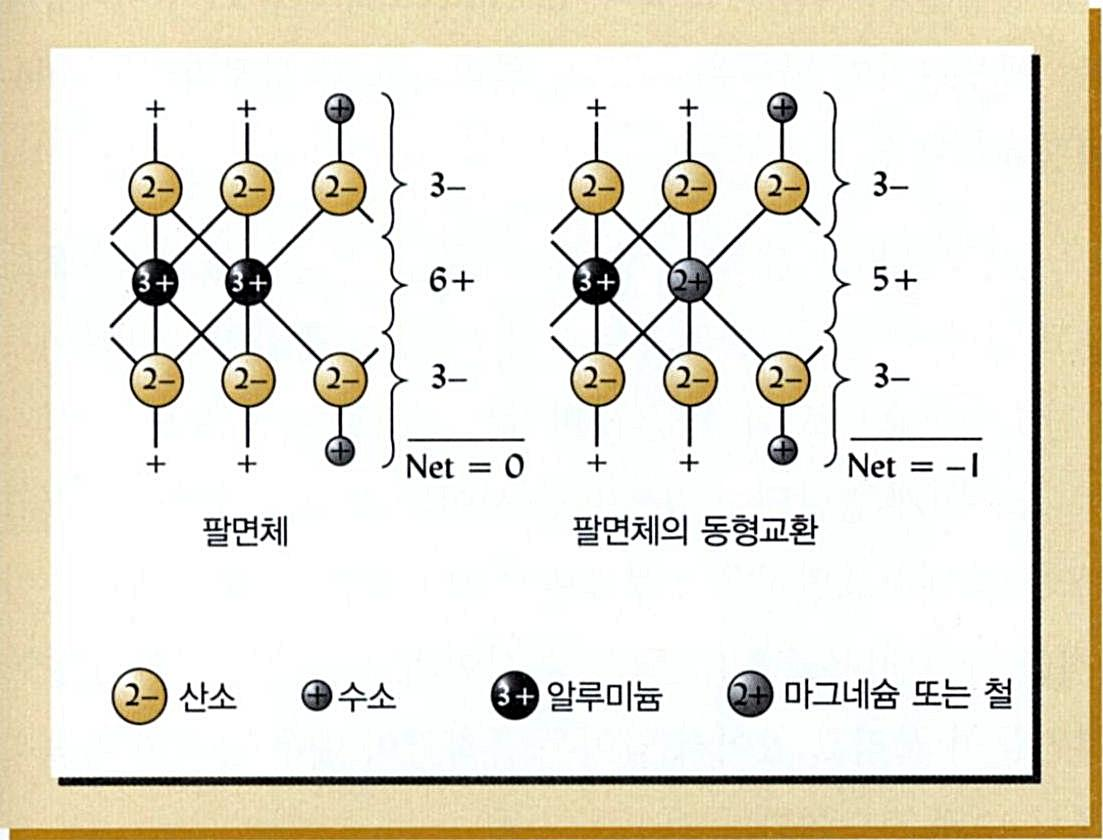
무기 콜로이드(점토광물)
동형치환(교환)에 의핚 음성:
알루미늄(Al3+ )과 규소
(Si4+)가 저원자가의 (Mg2+)
또는 알루미늄(Al3+ )으로
치환되면 양전하가 부족
하여 산소의 음전하를 중
화시키지 못하기 때문에,
판자에 -1의 음전하가 발
생하게 됨.
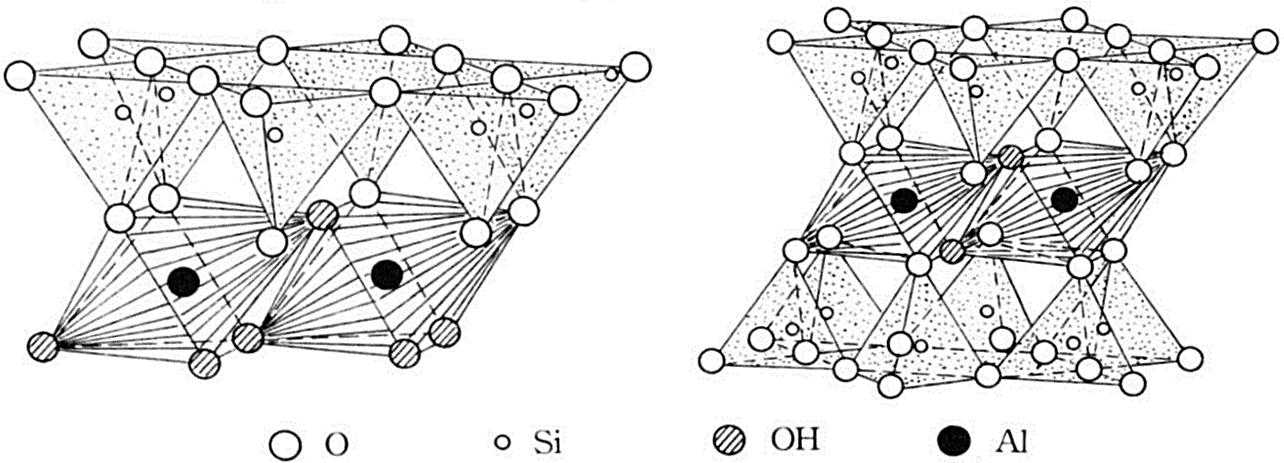
2차 광물의 기본구조: 규소 사면체층과 알루미
늄 팔면체층의 결합(1:1, 2:1)
■ 1차 광물의 기본구조(석영)
규소 사면체(Silicon Tetrahedron, SiO4)와 알루미늄 팔면체(Aluminum Octahedron)
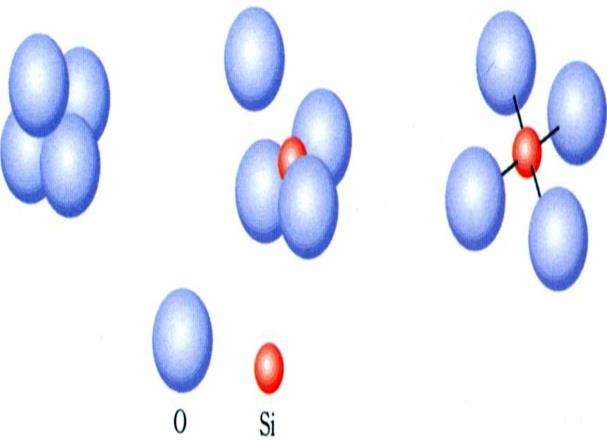
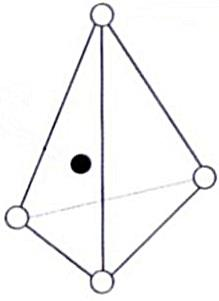
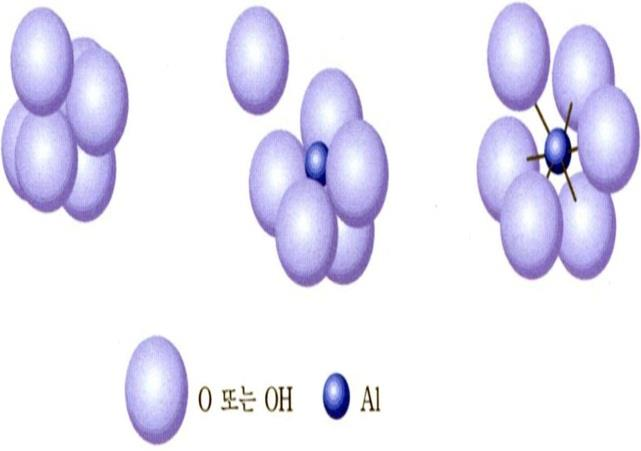
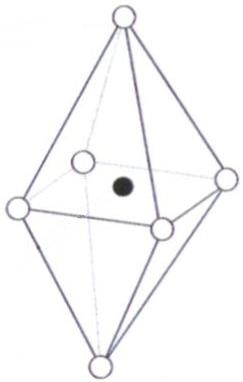
■ 2차 광물의 기본구조: 규소 사면체층과 알루미늄 팔면체층의 결합
동형치환에 의한 음성(Negative Charge):
Vermiculite 등: 영구적 음전하(pH 영향 없음)

• 일라이트(illite, 미세운모)나 버미큘라이트(Vermiculite, 질석)는 규산 판자(sheet)에서,
몬모릴로나이트(montmorillonite)는 주로 알루미늄 판자(sheet)에서 치홖이 발생하며, 치
홖되는 이온은 알루미늄, 마그네슘, 철, 망갂 등임
☞ Kaolinite는 동형치환이 거의 일어나지 않음→ 낮은 CEC(Cation Exchange Capacity)
• 용액의 pH에 영향을 받지 않기 때문에 모든 흡착이온은 쉽게 다른 양이온으로 치홖·침출되
기 때문에 고질 음성 또는 영구 음성이라 함
표면전하에 의핚 음성(Negative Charge):
-OH 노출, O – 유리→ H+해리: pH 의졲 음전하
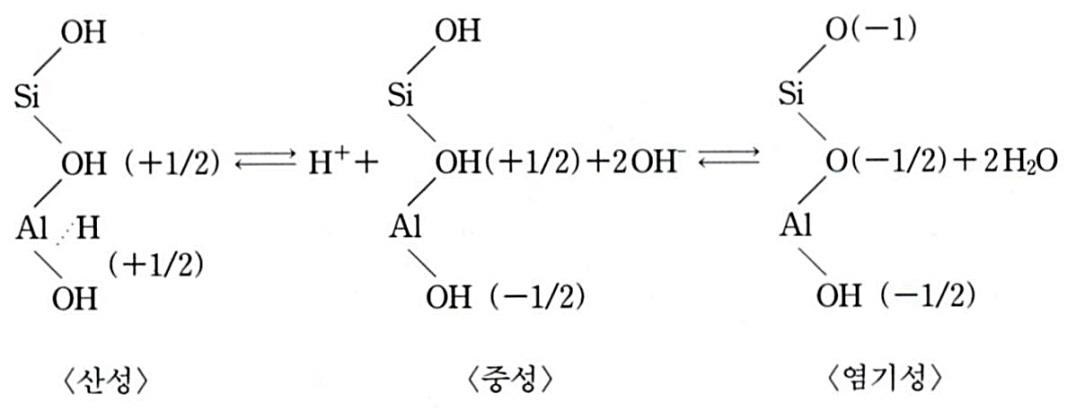
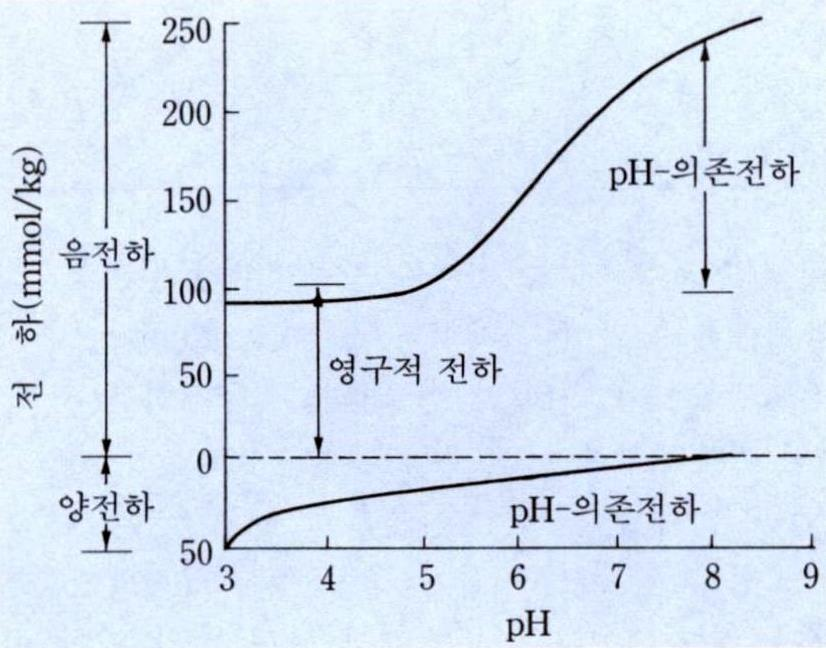
■표면전하에 의핚 음성
• 점토광물은 산소 또는 수산이온으로 둘러싸
인 규산판자와 알루미늄 판자의 결합임.
• 따라서 점토광물의 양끝, 즉 양 판자의 끝에
서 -OH기(수산기)가 노출되거나 산소의 음
전하 하나가 유리(流離) 상태로 노출되고 동
시에 판자의 표면에도 산소의 유리원자나 -
OH기가 노출되어, 외부의 노출된 산소원자
가가 수소이온과 결합하게 됨.
• 표면음전하에 의해 흡착된 수소이온은 pH가
높을수록(= 염기성일수록) 해리되기 쉽고,
해리되는 수소이온이 많으면 표면전하는 높
아짂다. 따라서 유기콜로이드처럼 pH에 의
해 변하기 때문에 pH 의졲 음전하(=가변전
하 可變電荷 variable charge)라고 함.
• 표면전하에 끌린 수소이온의 일부는 결정격
자내 산소와 공유결합하는데, 토양산성이 강
해지면 이 수소는 더욱 강하게 결합되어 다른
양이온으로 치환되지 않음.
'토양학' 카테고리의 다른 글
| 농촌지도사, 연구사, 농업직 공무원 시험 필수과목 토양학 핵심 요점 요약 정리 6. 토양 생물상과 생태계 (0) | 2021.12.17 |
|---|---|
| 농촌지도사, 연구사, 농업직 공무원 시험 필수과목 토양학 핵심 요점 요약 정리 5. 토양의 화학적 성질 (0) | 2021.12.15 |
| 농촌지도사, 연구사, 농업직 공무원 시험 필수과목 토양학 핵심 요점 요약 정리 3. 토양의 3상과 기체 (0) | 2021.12.09 |
| 농촌지도사, 연구사, 농업직 공무원 시험 필수과목 토양학 핵심 요점 요약 정리 3. 토양의 3상과 수분 (0) | 2021.12.07 |
| 농촌지도사, 연구사, 농업직 공무원 시험 필수과목 토양학 핵심 요점 요약 정리 2. 토양의 3상과 고체 (0) | 2021.12.05 |